吳江區INDeCTD
危機應對與應急遞交機制 在公共衛生緊急事件(如COVID-19)中,EMA允許簡化eCTD序列,優先審評關鍵模塊并暫緩非數據。申請人可通過快速通道(Fast Track)提交疫苗或藥物的eCTD資料,審評周期可壓縮至6個月。此類申請需附風險評估報告,并承諾后續補交完整數據。 數據安全與長期存檔 歐盟要求eCTD資料存檔期限至少為藥品上市后30年,EMA采用分布式存儲和區塊鏈技術確保數據不可篡改。申請人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協議(如AS2)遞交。歷史數據的遷移和格式轉換(如NeeS轉eCTD)需遵循特定技術規范。 環保效益與可持續發展 eCTD取代紙質遞交后,歐盟每年減少約500噸紙張消耗,審評流程的數字化降低碳足跡約30%。虛擬審評會議和電子簽名進一步減少了差旅需求,契合歐盟2050碳中和目標。未來,eCTD4.0將通過數據壓縮技術進一步降低服務器能耗。瑞士eCTD驗證標準相關技術支持。吳江區INDeCTD
2020年暴發后,FDA進一步推動電子化進程,例如允許遠程電子簽章和臨時放寬部分格式要求,但驗證標準(如PDF版本、書簽鏈接有效性)并未降低。這一時期的實踐為eCTD在緊急審批中的靈活性提供了案例,也凸顯了其作為危機應對工具的價值。 盡管美國尚未部署eCTD V4.0,但其技術方向已明確:支持醫療器械和保健品申報、增強數據可復用性、優化審評系統與人工智能的集成。此外,區塊鏈技術在電子簽章和數據溯源中的應用探索,可能成為下一階段升級的重點南京CDE eCTD格式加拿大eCTD驗證標準相關技術支持。

文件生命周期管理:eCTD支持文件替換(Replace)、刪除(Delete)等操作,而非增文件。例如,更臨床研究方案時需用Replace操作覆蓋舊版本。基線提交(Baseline Submission)可用于補充歷史紙質資料,但需在封面函中聲明無內容變更。 臨床數據與研究標簽文件(STF):模塊4和5中的研究數據需通過STF(Study Tagging Files)引用,確保數據與文檔關聯。FDA要求數據集(如SAS XPORT格式)能置于模塊3-5,且單個文件超過4GB需拆分。2022年統計顯示,58%的ANDA因研究數據技術拒絕標準(TRC)錯誤被拒。 電子簽名與表格要求:FDA表格(如356h、1571)需使用數字簽名,PDF文件禁止加密或設置編輯限制。電子簽名需符合21 CFR Part 11規范,確保身份驗證、不可否認性和數據完整性。 外包服務與系統解決方案:賦悅科技累計提交超2000份eCTD申請,外包可降低40%人工錯誤率。
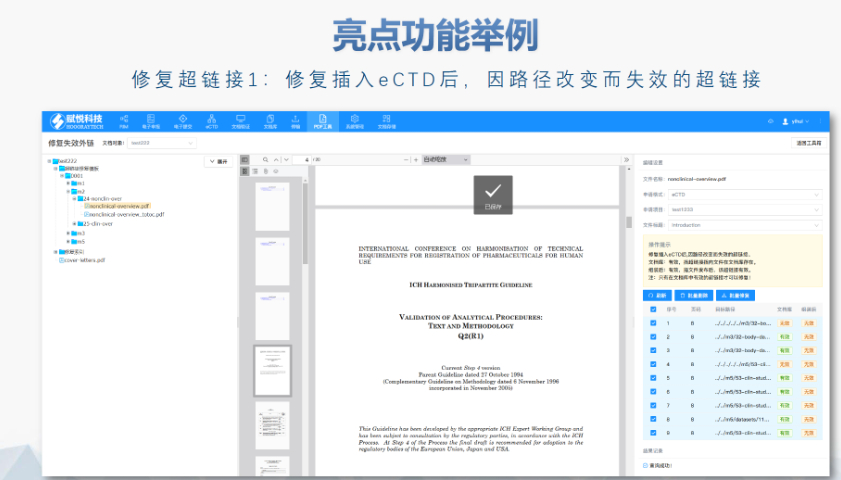
賦悅eCTD系統 ?文件驗證與修復 支持自動驗證文件格式(如PDF屬性、字體嵌入、超鏈接完整性等),并一鍵修復不符合法規要求的文件。例如,系統會自動檢查XML主干文件的結構合規性,確保符合中國、美國、歐盟等地區的eCTD法規標準。 ?eCTD組裝與發布 可自動生成符合CTD結構的電子文檔包,包括XML主干文件、文件夾命名規范及序列號管理(如申請號/序列號文件夾自動生成),并支持超鏈接和書簽的批量創建。例如,初次提交的序列號為0000,后續每次提交自動遞增。 ?生命周期管理 支持文件全生命周期操作(增、增補、替換、刪除),并通過序列號疊加直觀顯示各章節文件的有效性,覆蓋從初次提交到年報、撤市的全流程管理。 ?協同與權限管理 基于B/S架構(瀏覽器/服務器),支持云端或本地靈活部署,全集團賬號通用。提供多用戶協作功能,包括權限分級、審計追蹤、文件版本控制等。 ?法規支持與專業服務 內置符合中國CDE、美國FDA、歐盟EMA等法規的模板,同時提供注冊咨詢、資料撰寫、eCTD格式代轉等全流程支持,團隊擁有17年藥品注冊經驗。瑞士eCTD注冊外包相關技術支持。
美國電子提交通道ESG(Electronic Submissions Gateway)是美國食品藥品監督管理局(FDA)建立的電子化監管信息提交系統,旨在為制藥、生物制品、醫療器械等行業提供安全、高效的電子申報服務。自2006年啟用以來,ESG已成為FDA接收電子監管材料的入口,每日處理上千份提交文件,涵蓋上市前審批、上市后監管、臨床試驗數據、不良反應報告等多種類型。該系統通過數字證書加密和公鑰基礎設施(PKI)技術,確保文件傳輸的真實性、完整性和不可否認性,符合FDA對電子提交的嚴格合規要求。在技術層面,ESG具備強大的文件處理能力。2018年系統升級后,取消了單個文件8GB的限制,可支持高達35GB的大型文件提交,進一步滿足復雜申報需求。此外,文件格式需遵循eCTD(電子通用技術文檔)規范,包括模塊化結構、PDF標準化和XML元數據整合,以確保全球監管機構兼容性。2025年3月28日起,FDA將啟用新一代平臺ESG NextGen,逐步替代現有系統,過渡期需關注兼容性和穩定性問題。美國注冊鄧白氏號申請相關技術支持。上海原料藥eCTD使用
加拿大eCTD注冊外包相關技術支持。吳江區INDeCTD
GDUFA III框架與費用分類 2022年更的GDUFA III將費用分為ANDA申請費、DMF認證費、項目費及設施費四類,實施周期至2027年。2025財年ANDA費用漲至約22萬美元,較2024年增幅達27.5%,反映審評成本上升。 ?ANDA申請費規則 費用需在提交時繳納,若申請被拒可退還75%。重提交視為申請,需再次繳費。關聯API的工廠數量影響總費用,例如某ANDA引用3個API且涉及6家工廠,需支付6倍DMF費用。 ?DMF費用機制 II類原料藥DMF需在引用前繳費,一次性支付約5.3萬美元(2025財年)。未繳費DMF不得用于支持ANDA,否則觸發退審。 ?項目費分級管理 根據企業獲批ANDA數量分為大、中、小型三級,2025年大型企業年費約34萬美元。附屬公司ANDA數量合并計算,繳費責任可由母公司或任一附屬公司承擔。吳江區INDeCTD
- 浦東新區原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 蕪湖CDE eCTD服務電話 2025-04-25
- 杭州CDE eCTD品牌 2025-04-25
- 海南eCTD發布軟件 2025-04-25
- 閔行區賦悅科技eCTD軟件 2025-04-25
- 高新區生物制品eCTD服務電話 2025-04-25
- 太倉新藥eCTD發布系統 2025-04-25
- 化學藥品eCTD銷售電話 2025-04-25
- 蕪湖國際注冊eCTD服務放心可靠 2025-04-25
- 湘潭多功能汽車線束導通測試臺價格 2025-04-26
- 深圳佰歐達電子圖紙加密系統費用 2025-04-26
- 衢州智慧自動零售機器解決方案 2025-04-26
- 普陀區常見Matlab推薦 2025-04-26
- 青浦區什么是網站制作 2025-04-26
- 茂名智能指環智能戒指 2025-04-26
- 刷掌靜脈消費機生產廠家 2025-04-26
- 松江區什么是彩印包裝印刷聯系方式 2025-04-26
- 貴陽購買私域流量運營銷售公司 2025-04-26
- 松江區購買熱像儀配置 2025-04-26